- MÉTALLOGRAPHIE - Essais physico-chimiques
- MÉTALLOGRAPHIE - Essais physico-chimiquesEn métallurgie, les essais physico-chimiques visent à étudier, grâce à l’application des lois physiques, les propriétés physico-chimiques d’un matériau métallique dans des conditions données de milieu et de température. Ces essais présentent un double intérêt théorique et pratique, car ils sont utilisés quotidiennement dans les laboratoires de recherche et dans les entreprises industrielles. La comparaison des résultats que l’on peut tirer de ces essais permet d’améliorer la mise en œuvre des métaux. Cependant, si l’amélioration des techniques existantes entraîne des progrès dans la connaissance des propriétés des métaux, les progrès les plus importants sont bien souvent dus à l’introduction de nouvelles méthodes d’essais.Il n’est pas possible de dresser une liste exhaustive des techniques physico-chimiques dont dispose le métallurgiste tant elles sont nombreuses et variées. De plus, la distinction entre les différents types d’essais – physiques, chimiques et physico-chimiques – n’est pas nette. C’est plutôt par habitude qu’on fait un choix qui présente donc un caractère arbitraire. La classification proposée par C. Wagner permet de distinguer parmi les principales techniques:– Les mesures thermodynamiques dont les résultats sont en relation directe avec les équations générales de la thermodynamique ; ainsi, la calorimétrie permet d’atteindre les chaleurs molaires, les entropies molaires standards, les chaleurs de transformation, de fusion et de vaporisation, les chaleurs de réaction, les chaleurs partielles et totales de mélange; la mesure des pressions de vapeur permet de connaître les vitesses de vaporisation, les mécanismes de vaporisation et de condensation, les chaleurs et les énergies libres de formation et les entropies des espèces gazeuses et condensées; ces mesures servent encore à déterminer les énergies molaires partielles de Gibbs de mélange et les activités des alliages binaires, ou à composants multiples, déduites de pressions partielles, de forces électromotrices ou d’équilibres, ainsi que les énergies standards de Gibbs de réactions mettant en jeu des métaux, en particulier dans le cas de la formation des oxydes, des sulfures, des nitrures; enfin elles rendent possible l’étude des équilibres de phases: équilibres entre phases métalliques (une phase solide et une phase liquide), entre une phase métallique et une phase gazeuse et impliquant un phénomène de dissolution du gaz, entre une phase métallique et une phase gazeuse comprenant un composé volatil tel qu’un oxyde, entre une phase solide ou une phase liquide et un laitier, entre une phase métallique solide ou liquide et une solution solide d’oxydes.– Les mesures cinétiques qui se rapportent à tous les phénomènes évoluant en fonction du temps et, notamment, la diffusion dans les alliages solides et liquides, la diffusion superficielle, la germination, la solidification, les réactions de précipitation, les vitesses de vaporisation, les réactions gaz-métal telles l’absorption ou la désorption faisant intervenir la diffusion des gaz dans les métaux solides ou liquides, les réactions alliage-laitier, la corrosion sèche des métaux à haute température, la corrosion dans les solutions aqueuses ou non.– Les mesures mixtes comprenant des méthodes variées qui visent à étudier des propriétés essentiellement physiques comme la densité, la viscosité, l’énergie superficielle. En revanche, les propriétés électriques et magnétiques ou encore les propriétés mécaniques sont envisagées à part.Ces essais considèrent un matériau métallique dans deux situations bien distinctes: d’une part, à l’équilibre (au sens thermodynamique du terme) et, d’autre part, lorsqu’il évolue avec le temps. C’est ce mode de classification qui sera adopté ici pour décrire quelques essais parmi ceux auxquels le métallurgiste fait le plus souvent appel.1. Comportement à l’équilibre d’un matériau métalliqueMesure des pressions de vapeurEn métallurgie, la phase gazeuse est souvent constituée par la vapeur de l’un des composés condensés qui a une tension de vapeur mesurable.Les méthodes statiquesLes techniques statiques sont les plus simples et ont été utilisées pour la première fois en 1803 par J. Dalton. Leur principe consiste à enfermer sous vide le matériau à étudier dans un appareil et à mesurer directement la pression lorsque l’équilibre est atteint. Elles conviennent mieux pour des tensions de vapeur élevées que pour des tensions assez faibles.Parmi les nombreuses applications, on peut citer l’étude du mercure et des amalgames à des températures voisines de 300 0C et l’étude entre 1 300 0C et 1 700 0C de l’équilibre:
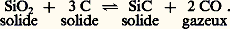 Les méthodes dynamiquesLa détermination de la température d’ébullition d’un métal ou d’un composé est un exemple d’utilisation des méthodes dynamiques. La méthode la plus générale, dite méthode de transport, consiste à faire passer sur la substance maintenue à une température constante un courant de gaz inerte à débit et à pression constants. Ce gaz entraîne la vapeur ou le composé volatil à une vitesse qui dépend à la fois des pressions relatives et du débit gazeux. La vapeur est condensée ou recueillie dans une partie froide de l’appareil; l’analyse de ce condensat permet de mesurer la vitesse d’élimination de la vapeur à différentes vitesses de passage du gaz.Mesure des vitesses de vaporisationLes méthodes de mesure des vitesses de vaporisation consistent à déterminer la tension de vapeur d’une substance d’après sa vitesse de vaporisation sous vide. On calcule la pression à l’aide de la formule:
Les méthodes dynamiquesLa détermination de la température d’ébullition d’un métal ou d’un composé est un exemple d’utilisation des méthodes dynamiques. La méthode la plus générale, dite méthode de transport, consiste à faire passer sur la substance maintenue à une température constante un courant de gaz inerte à débit et à pression constants. Ce gaz entraîne la vapeur ou le composé volatil à une vitesse qui dépend à la fois des pressions relatives et du débit gazeux. La vapeur est condensée ou recueillie dans une partie froide de l’appareil; l’analyse de ce condensat permet de mesurer la vitesse d’élimination de la vapeur à différentes vitesses de passage du gaz.Mesure des vitesses de vaporisationLes méthodes de mesure des vitesses de vaporisation consistent à déterminer la tension de vapeur d’une substance d’après sa vitesse de vaporisation sous vide. On calcule la pression à l’aide de la formule: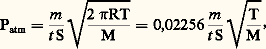 où m est la perte de poids de l’échantillon, c’est-à-dire la masse de vapeur (g), M la masse moléculaire de la vapeur, S l’aire de la surface d’évaporation (cm2), T la température absolue et t le temps (s). Deux méthodes sont surtout utilisées.La méthode de Knudsen dans laquelle la substance est enfermée dans une ampoule comportant un petit orifice de surface S. On pèse l’ampoule et son contenu avant et après l’essai effectué pendant un temps connu à température constante et sous un très bon vide. Des améliorations ont été apportées à cette technique en utilisant non plus une ampoule mais une cellule suspendue à un fil mince. Cette cellule comporte deux petits trous excentrés par rapport à la fixation du fil (fig. 1). Lorsque la vapeur s’échappe, la cellule tourne d’un certain angle sous l’influence du couple de torsion ainsi formé: c’est la méthode d’effusion-torsion. On atteint la tension de vapeur P à l’aide de la formule:
où m est la perte de poids de l’échantillon, c’est-à-dire la masse de vapeur (g), M la masse moléculaire de la vapeur, S l’aire de la surface d’évaporation (cm2), T la température absolue et t le temps (s). Deux méthodes sont surtout utilisées.La méthode de Knudsen dans laquelle la substance est enfermée dans une ampoule comportant un petit orifice de surface S. On pèse l’ampoule et son contenu avant et après l’essai effectué pendant un temps connu à température constante et sous un très bon vide. Des améliorations ont été apportées à cette technique en utilisant non plus une ampoule mais une cellule suspendue à un fil mince. Cette cellule comporte deux petits trous excentrés par rapport à la fixation du fil (fig. 1). Lorsque la vapeur s’échappe, la cellule tourne d’un certain angle sous l’influence du couple de torsion ainsi formé: c’est la méthode d’effusion-torsion. On atteint la tension de vapeur P à l’aide de la formule: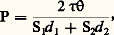 où 精 est la constante de torsion du fil de suspension, la déflexion angulaire, S1 et S2 les aires des orifices situés aux distances d 1 et d 2 de l’axe de suspension (fig. 1). Certains appareils permettent de mesurer simultanément la pression de vapeur par les techniques de perte de poids et d’effusion-torsion; on obtient alors la pression et le poids moléculaire moyen. À l’aide de cette technique double, il a été montré, par exemple, que la vapeur de chlorure de béryllium BeCl2 contient 98 梁 2 p. 100 de BeCl2 monomère.Des variantes à la technique de perte de poids ont été utilisées en condensant une fraction connue de masse m de la phase vapeur sur une cible circulaire de rayon r placée coaxialement à une distance D de l’orifice. La pression P est alors:
où 精 est la constante de torsion du fil de suspension, la déflexion angulaire, S1 et S2 les aires des orifices situés aux distances d 1 et d 2 de l’axe de suspension (fig. 1). Certains appareils permettent de mesurer simultanément la pression de vapeur par les techniques de perte de poids et d’effusion-torsion; on obtient alors la pression et le poids moléculaire moyen. À l’aide de cette technique double, il a été montré, par exemple, que la vapeur de chlorure de béryllium BeCl2 contient 98 梁 2 p. 100 de BeCl2 monomère.Des variantes à la technique de perte de poids ont été utilisées en condensant une fraction connue de masse m de la phase vapeur sur une cible circulaire de rayon r placée coaxialement à une distance D de l’orifice. La pression P est alors: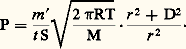 Il est possible de combiner la méthode d’effusion et l’utilisation des radiotraceurs. Dans ce cas, on détermine la pression de vapeur d’une substance radioactive en mesurant par comptage, à l’aide d’un compteur Geiger, la quantité de matière déposée sur la paroi collectrice. Cela a été appliqué au cas du chrome et des alliages argent-silicium.Le chauffage de l’échantillon, suivant la température désirée, est obtenu par effet Joule, par induction, par rayonnement à l’aide d’un four (jusqu’à 1 400 0C) ou encore par bombardement électronique.La méthode de Langmuir consiste à mesurer la vitesse de vaporisation libre à partir de la surface d’un échantillon chauffé sous vide. Langmuir a ainsi mesuré directement la vitesse d’évaporation de fils métalliques chauffés par le passage d’un courant électrique. La vitesse de vaporisation est:
Il est possible de combiner la méthode d’effusion et l’utilisation des radiotraceurs. Dans ce cas, on détermine la pression de vapeur d’une substance radioactive en mesurant par comptage, à l’aide d’un compteur Geiger, la quantité de matière déposée sur la paroi collectrice. Cela a été appliqué au cas du chrome et des alliages argent-silicium.Le chauffage de l’échantillon, suivant la température désirée, est obtenu par effet Joule, par induction, par rayonnement à l’aide d’un four (jusqu’à 1 400 0C) ou encore par bombardement électronique.La méthode de Langmuir consiste à mesurer la vitesse de vaporisation libre à partir de la surface d’un échantillon chauffé sous vide. Langmuir a ainsi mesuré directement la vitesse d’évaporation de fils métalliques chauffés par le passage d’un courant électrique. La vitesse de vaporisation est: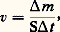 Il est important de remarquer que v dépend de l’orientation cristallographique. En utilisant des échantillons monocristallins, il est possible de déterminer v en fonction de l’orientation cristallographique de la surface. Au contraire, pour un échantillon polycristallin, on n’obtient qu’une valeur moyenne de v.Afin d’obtenir une bonne précision, on utilise souvent une microbalance pouvant mesurer des différences de poids de 10-5 à 10-7 g; cela permet, de plus, de déterminer la vitesse instantanée.Comme dans la méthode de Knudsen, il est possible de condenser la phase vapeur sur une paroi froide et d’analyser le condensat par une méthode physique convenable.Dans le domaine de la mesure des pressions de vapeur, la spectrométrie de masse rend de grands services. C’est en effet la technique de choix pour déterminer la nature des espèces vaporisées quand plusieurs espèces coexistent dans la phase vapeur.Il a été ainsi montré que Al, AlO, Al2O, d’une part, et CrO, Cr2, Cr3, d’autre part, sont les espèces vapeurs en équilibre respectivement avec Al23 et Cr23. Cette méthode présente le grand avantage d’opérer jusqu’à des pressions très faibles de l’ordre de 10-6 Pa. Son développement a été toutefois limité du fait qu’elle n’est pas absolue; l’étalonnage est d’ailleurs fait en général à partir d’une vitesse d’évaporation d’un système connu.En plus de son intérêt théorique, la connaissance des tensions de vapeur des métaux purs et des alliages présente un intérêt pratique. C’est ainsi, par exemple, que les diagrammes donnant la variation des températures d’ébullition en fonction de la composition des alliages (fig. 2) fournissent des indications précieuses sur la possibilité de raffinage des métaux par simple distillation (Zn-Pb) ou par distillation fractionnée (Zn-Cd).Mesure des forces électromotricesLes piles électrochimiques ont été utilisées avec succès depuis de nombreuses années pour déterminer des grandeurs thermodynamiques, notamment les variations d’enthalpie libre de Gibbs et les activités. La relation entre la force électromotrice (f.é.m.) E d’une pile réversible et la variation d’enthalpie libre de Gibbs G0 pour la réaction chimique virtuelle associée à cette pile s’exprime par:
Il est important de remarquer que v dépend de l’orientation cristallographique. En utilisant des échantillons monocristallins, il est possible de déterminer v en fonction de l’orientation cristallographique de la surface. Au contraire, pour un échantillon polycristallin, on n’obtient qu’une valeur moyenne de v.Afin d’obtenir une bonne précision, on utilise souvent une microbalance pouvant mesurer des différences de poids de 10-5 à 10-7 g; cela permet, de plus, de déterminer la vitesse instantanée.Comme dans la méthode de Knudsen, il est possible de condenser la phase vapeur sur une paroi froide et d’analyser le condensat par une méthode physique convenable.Dans le domaine de la mesure des pressions de vapeur, la spectrométrie de masse rend de grands services. C’est en effet la technique de choix pour déterminer la nature des espèces vaporisées quand plusieurs espèces coexistent dans la phase vapeur.Il a été ainsi montré que Al, AlO, Al2O, d’une part, et CrO, Cr2, Cr3, d’autre part, sont les espèces vapeurs en équilibre respectivement avec Al23 et Cr23. Cette méthode présente le grand avantage d’opérer jusqu’à des pressions très faibles de l’ordre de 10-6 Pa. Son développement a été toutefois limité du fait qu’elle n’est pas absolue; l’étalonnage est d’ailleurs fait en général à partir d’une vitesse d’évaporation d’un système connu.En plus de son intérêt théorique, la connaissance des tensions de vapeur des métaux purs et des alliages présente un intérêt pratique. C’est ainsi, par exemple, que les diagrammes donnant la variation des températures d’ébullition en fonction de la composition des alliages (fig. 2) fournissent des indications précieuses sur la possibilité de raffinage des métaux par simple distillation (Zn-Pb) ou par distillation fractionnée (Zn-Cd).Mesure des forces électromotricesLes piles électrochimiques ont été utilisées avec succès depuis de nombreuses années pour déterminer des grandeurs thermodynamiques, notamment les variations d’enthalpie libre de Gibbs et les activités. La relation entre la force électromotrice (f.é.m.) E d’une pile réversible et la variation d’enthalpie libre de Gibbs G0 pour la réaction chimique virtuelle associée à cette pile s’exprime par: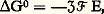 où 率 est la valence et 杻 le faraday (9,648 7 憐 104 C).Par exemple, l’énergie libre de Gibbs de formation de HCl, GHCl0 , peut être mesurée à l’aide de la pile:
où 率 est la valence et 杻 le faraday (9,648 7 憐 104 C).Par exemple, l’énergie libre de Gibbs de formation de HCl, GHCl0 , peut être mesurée à l’aide de la pile: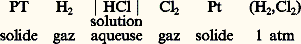 La f.é.m. E est mesurée par une méthode de compensation à l’aide d’un potentiomètre.Des piles mettant en jeu une électrode solide ont été utilisées pour étudier les alliages métalliques, notamment pour la mise en solution du zinc dans les laitons 見:
La f.é.m. E est mesurée par une méthode de compensation à l’aide d’un potentiomètre.Des piles mettant en jeu une électrode solide ont été utilisées pour étudier les alliages métalliques, notamment pour la mise en solution du zinc dans les laitons 見: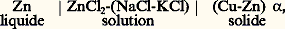 ou encore pour déterminer l’activité de l’argent dans les alliages Ag-Au (fig. 3).Afin d’assurer une diffusion rapide aux électrodes, la température pour un tel système à électrode solide doit être suffisamment élevée.Selon le même principe, de nombreux chlorures ont été étudiés à l’aide de ce type de piles:
ou encore pour déterminer l’activité de l’argent dans les alliages Ag-Au (fig. 3).Afin d’assurer une diffusion rapide aux électrodes, la température pour un tel système à électrode solide doit être suffisamment élevée.Selon le même principe, de nombreux chlorures ont été étudiés à l’aide de ce type de piles: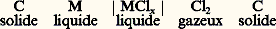 L’usage de chlorures alcalins comme solvant ou comme électrolyte est très répandu, mais il est limité à des températures n’excédant pas en général 700 0C.À la suite des travaux de Wagner et Kiukkola sur les défauts et la conductivité dans les composés ioniques, les oxydes ont été largement utilisés comme électrolytes solides, notamment pour mesurer les activités de l’oxygène dans les électrodes solides, liquides et gazeuses. L’oxyde, dans ce cas, doit être un conducteur ionique pur, c’est-à-dire que le nombre de transport de l’oxygène doit être voisin de l’unité. On utilise très souvent des solutions d’oxydes de calcium, d’yttrium ou de lanthane dans les oxydes de zirconium (fig. 4) ou de thorium, qui ont une structure du type fluorine. Les solutions solides à base de thorine sont des conducteurs ioniques purs pour un vaste domaine de pression d’oxygène compris entre 10-1 et 10-23 Pa. De nombreuses applications de ces électrolytes solides ont été faites pour déterminer:– les changements d’énergie libre de Gibbs et les potentiels chimiques de l’oxygène dans les systèmes métal-oxyde, par exemple à l’aide de la pile:
L’usage de chlorures alcalins comme solvant ou comme électrolyte est très répandu, mais il est limité à des températures n’excédant pas en général 700 0C.À la suite des travaux de Wagner et Kiukkola sur les défauts et la conductivité dans les composés ioniques, les oxydes ont été largement utilisés comme électrolytes solides, notamment pour mesurer les activités de l’oxygène dans les électrodes solides, liquides et gazeuses. L’oxyde, dans ce cas, doit être un conducteur ionique pur, c’est-à-dire que le nombre de transport de l’oxygène doit être voisin de l’unité. On utilise très souvent des solutions d’oxydes de calcium, d’yttrium ou de lanthane dans les oxydes de zirconium (fig. 4) ou de thorium, qui ont une structure du type fluorine. Les solutions solides à base de thorine sont des conducteurs ioniques purs pour un vaste domaine de pression d’oxygène compris entre 10-1 et 10-23 Pa. De nombreuses applications de ces électrolytes solides ont été faites pour déterminer:– les changements d’énergie libre de Gibbs et les potentiels chimiques de l’oxygène dans les systèmes métal-oxyde, par exemple à l’aide de la pile: – les potentiels chimiques de l’oxygène dissous dans les métaux, notamment dans le fer et le cuivre;– les potentiels chimiques dans les alliages tels que Cu-Ni:
– les potentiels chimiques de l’oxygène dissous dans les métaux, notamment dans le fer et le cuivre;– les potentiels chimiques dans les alliages tels que Cu-Ni: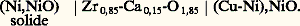 La précision obtenue est en général très bonne. Cette méthode moderne est donc extrêmement fructueuse; des essais prospectifs sont réalisés en laboratoire pour la développer dans le cas d’autres composés comme les nitrures, les carbures et les borures.Weissbart et Ruka ont estimé que de telles piles à concentration d’oxygène et comprenant un électrolyte solide pouvaient, en plus des diverses applications envisagées ci-dessus, être employées pour mesurer les concentrations d’oxygène dans les gaz à haute température. En effet, la différence de potentiel E qui existe entre les deux électrodes de la pile:
La précision obtenue est en général très bonne. Cette méthode moderne est donc extrêmement fructueuse; des essais prospectifs sont réalisés en laboratoire pour la développer dans le cas d’autres composés comme les nitrures, les carbures et les borures.Weissbart et Ruka ont estimé que de telles piles à concentration d’oxygène et comprenant un électrolyte solide pouvaient, en plus des diverses applications envisagées ci-dessus, être employées pour mesurer les concentrations d’oxygène dans les gaz à haute température. En effet, la différence de potentiel E qui existe entre les deux électrodes de la pile: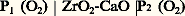 est directement reliée au rapport des pressions partielles d’oxygène P1 et P2 suivant la formule:
est directement reliée au rapport des pressions partielles d’oxygène P1 et P2 suivant la formule: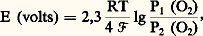 où R est la constante des gaz parfaits, T la température absolue et 杻 le faraday. En connaissant P1, il est aisé de déterminer P2. Des sondes à oxygène ont été réalisées sur ce principe et sont utilisées maintenant industriellement. Dans certains cas, en effet, la composition de l’atmosphère est un facteur important qui conditionne les propriétés du produit fabriqué et il est alors nécessaire de connaître in situ cette composition et de la contrôler. De telles sondes, d’un emploi facile, permettent de résoudre ce problème des exemples de ce type de mesures.2. Étude cinétique du comportement d’un matériau métalliqueLes essais cinétiques ont pour but d’étudier le comportement d’un métal dans un milieu donné, en fonction du temps. Les essais de corrosion sèche ou électrochimique ainsi que les mesures d’absorption de gaz constituent des exemples de ce type de mesures.Essais de corrosion sècheLe problème revient très généralement à étudier la formation d’une couche de produit de corrosion, en particulier d’une couche d’oxyde, à la surface d’un métal ou d’un alliage soumis à l’action d’un gaz à haute température. Les méthodes expérimentales diffèrent suivant qu’on désire étudier la cinétique d’oxydation, la morphologie, la nature ou la structure de l’oxyde, adhérant au métal ou pris isolément, ou encore les modifications des propriétés du substrat métallique entraînées par cette oxydation.La thermogravimétrie est la méthode la plus usuelle pour étudier la vitesse d’oxydation d’un métal ou d’un alliage; elle met en jeu l’utilisation d’une thermobalance qui permet d’atteindre, à l’aide d’un étalonnage, la masse d’oxyde formé en fonction du temps, pour des conditions données d’atmosphère gazeuse, de température et de pression. Plusieurs types de thermobalances de différentes sensibilités ont été mis au point suivant qu’on étudie l’adsorption, la formation des couches minces ou des couches épaisses. Ainsi, pour étudier les couches très minces, on a recours à des appareils ayant une sensibilité meilleure que 10-6, voire 10-8 g: thermobalances de Gulbransen et de Cahn.Pour des couches plus épaisses nécessitant une sensibilité moins grande, on peut utiliser des thermobalances de différents types (fig. 5, 6 et 7). Dans cette dernière, on suit, à l’aide d’un cathétomètre, l’allongement d’un ressort auquel est suspendu l’échantillon; par un étalonnage convenable, on détermine l’augmentation de masse, et on peut alors tracer les courbes cinétiques isothermes (fig. 8).Au lieu de prendre l’augmentation de poids comme paramètre pour suivre l’évolution de la réaction, on peut aussi bien suivre la diminution de pression du gaz à volume constant ou la diminution de volume à pression constante: ce sont respectivement les méthodes manométrique et volumétrique. Elles sont parfois plus sensibles que les méthodes gravimétriques mais d’une mise en œuvre plus délicate.Tous ces essais ne fournissent qu’une information globale. Il est donc indispensable d’effectuer des essais complémentaires, notamment d’observer la morphologie de l’échantillon après l’essai, afin de déceler la présence éventuelle de plusieurs couches d’oxyde ou encore de défauts tels que des pores ou des fissures. D’une façon générale, tous les renseignements sur la morphologie et la structure sont nécessaires pour une bonne compréhension du phénomène étudié.Une méthode plus moderne et plus originale consiste à déterminer la non-stœchiométrie, la conductivité et les mécanismes de transport dans les oxydes, qui régissent l’avancement des réactions en corrosion sèche. Les essais de diffusion sous champ électrique à haute température, appelés essais d’électrotransport ou d’électrolyse à l’état solide, permettent de mettre clairement en évidence la nature du ou des défauts réticulaires propres à un oxyde et de préciser si la croissance du film d’oxyde est due à la diffusion préférentielle soit des anions oxygène, soit des cations et si elle obéit, par exemple, à la loi cinétique parabolique émise il y a plus de cinquante ans par C. Wagner. Le principe de ces essais est dû à Tubandt qui, en 1921, fut le premier à réaliser l’électrolyse d’un composé ionique, en appliquant un champ électrique continu à travers une pastille d’iodure d’argent AgI placée entre une anode en argent et une cathode en platine. Ces essais ont été depuis étendus à d’autres composés ioniques et aux oxydes.Essais de corrosion électrochimiqueLa corrosion électrochimique correspond à la dissolution d’un matériau métallique plongé dans une solution, selon une réaction électrochimique anodique. Pour examiner la cinétique et la thermodynamique de ce processus ainsi que les propriétés des produits de corrosion, les techniques sont également très variées, comme en corrosion sèche.La vitesse de corrosion peut être obtenue à partir des mesures de pertes de poids de l’échantillon métallique ou à partir de l’analyse des produits de corrosion. Les résultats obtenus sont généralement rapportés à l’ensemble de la surface de la pièce; mais, en fait, il est indispensable d’effectuer des contrôles soignés par observation métallographique pour s’assurer s’il y a ou non des attaques localisées.La méthode la plus courante pour étudier la corrosion électrochimique consiste à déterminer et à étudier les courbes intensité-potentiel qui caractérisent les processus électrochimiques. Ces courbes sont tracées à l’aide d’un potentiostat, appareil qui permet de faire varier le potentiel appliqué au métal et de mesurer l’intensité du courant qui circule alors entre le métal et la contre-électrode (fig. 9). La figure 10 présente les courbes intensité-potentiel obtenues pour deux aciers de composition différente, illustrant l’influence très marquée du chrome sur le phénomène de passivation.Cette méthode dite potentiocinétique peut être dans certains cas remplacée par la méthode intensiocinétique, qui consiste à faire varier l’intensité du courant qui circule entre les deux électrodes et à mesurer le potentiel du métal. À partir de ces courbes intensité-potentiel, il est possible de déterminer le potentiel de dissolution et l’intensité du courant de corrosion, i c . La vitesse moyenne de corrosion, v (g/s), est alors:
où R est la constante des gaz parfaits, T la température absolue et 杻 le faraday. En connaissant P1, il est aisé de déterminer P2. Des sondes à oxygène ont été réalisées sur ce principe et sont utilisées maintenant industriellement. Dans certains cas, en effet, la composition de l’atmosphère est un facteur important qui conditionne les propriétés du produit fabriqué et il est alors nécessaire de connaître in situ cette composition et de la contrôler. De telles sondes, d’un emploi facile, permettent de résoudre ce problème des exemples de ce type de mesures.2. Étude cinétique du comportement d’un matériau métalliqueLes essais cinétiques ont pour but d’étudier le comportement d’un métal dans un milieu donné, en fonction du temps. Les essais de corrosion sèche ou électrochimique ainsi que les mesures d’absorption de gaz constituent des exemples de ce type de mesures.Essais de corrosion sècheLe problème revient très généralement à étudier la formation d’une couche de produit de corrosion, en particulier d’une couche d’oxyde, à la surface d’un métal ou d’un alliage soumis à l’action d’un gaz à haute température. Les méthodes expérimentales diffèrent suivant qu’on désire étudier la cinétique d’oxydation, la morphologie, la nature ou la structure de l’oxyde, adhérant au métal ou pris isolément, ou encore les modifications des propriétés du substrat métallique entraînées par cette oxydation.La thermogravimétrie est la méthode la plus usuelle pour étudier la vitesse d’oxydation d’un métal ou d’un alliage; elle met en jeu l’utilisation d’une thermobalance qui permet d’atteindre, à l’aide d’un étalonnage, la masse d’oxyde formé en fonction du temps, pour des conditions données d’atmosphère gazeuse, de température et de pression. Plusieurs types de thermobalances de différentes sensibilités ont été mis au point suivant qu’on étudie l’adsorption, la formation des couches minces ou des couches épaisses. Ainsi, pour étudier les couches très minces, on a recours à des appareils ayant une sensibilité meilleure que 10-6, voire 10-8 g: thermobalances de Gulbransen et de Cahn.Pour des couches plus épaisses nécessitant une sensibilité moins grande, on peut utiliser des thermobalances de différents types (fig. 5, 6 et 7). Dans cette dernière, on suit, à l’aide d’un cathétomètre, l’allongement d’un ressort auquel est suspendu l’échantillon; par un étalonnage convenable, on détermine l’augmentation de masse, et on peut alors tracer les courbes cinétiques isothermes (fig. 8).Au lieu de prendre l’augmentation de poids comme paramètre pour suivre l’évolution de la réaction, on peut aussi bien suivre la diminution de pression du gaz à volume constant ou la diminution de volume à pression constante: ce sont respectivement les méthodes manométrique et volumétrique. Elles sont parfois plus sensibles que les méthodes gravimétriques mais d’une mise en œuvre plus délicate.Tous ces essais ne fournissent qu’une information globale. Il est donc indispensable d’effectuer des essais complémentaires, notamment d’observer la morphologie de l’échantillon après l’essai, afin de déceler la présence éventuelle de plusieurs couches d’oxyde ou encore de défauts tels que des pores ou des fissures. D’une façon générale, tous les renseignements sur la morphologie et la structure sont nécessaires pour une bonne compréhension du phénomène étudié.Une méthode plus moderne et plus originale consiste à déterminer la non-stœchiométrie, la conductivité et les mécanismes de transport dans les oxydes, qui régissent l’avancement des réactions en corrosion sèche. Les essais de diffusion sous champ électrique à haute température, appelés essais d’électrotransport ou d’électrolyse à l’état solide, permettent de mettre clairement en évidence la nature du ou des défauts réticulaires propres à un oxyde et de préciser si la croissance du film d’oxyde est due à la diffusion préférentielle soit des anions oxygène, soit des cations et si elle obéit, par exemple, à la loi cinétique parabolique émise il y a plus de cinquante ans par C. Wagner. Le principe de ces essais est dû à Tubandt qui, en 1921, fut le premier à réaliser l’électrolyse d’un composé ionique, en appliquant un champ électrique continu à travers une pastille d’iodure d’argent AgI placée entre une anode en argent et une cathode en platine. Ces essais ont été depuis étendus à d’autres composés ioniques et aux oxydes.Essais de corrosion électrochimiqueLa corrosion électrochimique correspond à la dissolution d’un matériau métallique plongé dans une solution, selon une réaction électrochimique anodique. Pour examiner la cinétique et la thermodynamique de ce processus ainsi que les propriétés des produits de corrosion, les techniques sont également très variées, comme en corrosion sèche.La vitesse de corrosion peut être obtenue à partir des mesures de pertes de poids de l’échantillon métallique ou à partir de l’analyse des produits de corrosion. Les résultats obtenus sont généralement rapportés à l’ensemble de la surface de la pièce; mais, en fait, il est indispensable d’effectuer des contrôles soignés par observation métallographique pour s’assurer s’il y a ou non des attaques localisées.La méthode la plus courante pour étudier la corrosion électrochimique consiste à déterminer et à étudier les courbes intensité-potentiel qui caractérisent les processus électrochimiques. Ces courbes sont tracées à l’aide d’un potentiostat, appareil qui permet de faire varier le potentiel appliqué au métal et de mesurer l’intensité du courant qui circule alors entre le métal et la contre-électrode (fig. 9). La figure 10 présente les courbes intensité-potentiel obtenues pour deux aciers de composition différente, illustrant l’influence très marquée du chrome sur le phénomène de passivation.Cette méthode dite potentiocinétique peut être dans certains cas remplacée par la méthode intensiocinétique, qui consiste à faire varier l’intensité du courant qui circule entre les deux électrodes et à mesurer le potentiel du métal. À partir de ces courbes intensité-potentiel, il est possible de déterminer le potentiel de dissolution et l’intensité du courant de corrosion, i c . La vitesse moyenne de corrosion, v (g/s), est alors: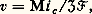 où M est le poids atomique ou moléculaire, 率 la valence et 杻 le faraday (face=F0019 力 96 500 coulombs). Les courbes de polarisation permettent de déterminer le potentiel de corrosion Ecorr d’un métal ou d’un alliage dans un milieu donné; c’est le potentiel pour lequel le courant global est nul (l’intensité du courant anodique i A est égale, en valeur absolue, à l’intensité du courant cathodique i c . L’utilisation de ces courbes, dans le cas d’une polarisation de transfert de charge conduit, par la méthode de Stern qui consiste à extrapoler les droites de Tafel, à déterminer le courant de corrosion Icorr (fig. 11), et donc la vitesse de corrosion au potentiel libre. La chute ohmique, le transfert de matière par diffusion, la complexité des réactions, le caractère actif ou passif de la surface, sont des phénomènes qui peuvent perturber l’exploitation mentionnée précédemment. Pour s’en affranchir, on mesure la résistance de polarisation Rp, pente
où M est le poids atomique ou moléculaire, 率 la valence et 杻 le faraday (face=F0019 力 96 500 coulombs). Les courbes de polarisation permettent de déterminer le potentiel de corrosion Ecorr d’un métal ou d’un alliage dans un milieu donné; c’est le potentiel pour lequel le courant global est nul (l’intensité du courant anodique i A est égale, en valeur absolue, à l’intensité du courant cathodique i c . L’utilisation de ces courbes, dans le cas d’une polarisation de transfert de charge conduit, par la méthode de Stern qui consiste à extrapoler les droites de Tafel, à déterminer le courant de corrosion Icorr (fig. 11), et donc la vitesse de corrosion au potentiel libre. La chute ohmique, le transfert de matière par diffusion, la complexité des réactions, le caractère actif ou passif de la surface, sont des phénomènes qui peuvent perturber l’exploitation mentionnée précédemment. Pour s’en affranchir, on mesure la résistance de polarisation Rp, pente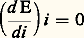 de la caractéristique I/E, stationnaire au potentiel de corrosion. En faisant l’hypothèse de lois exponentielles entre les parties anodique et cathodique, on aboutit à la relation de Stern et Geary:
de la caractéristique I/E, stationnaire au potentiel de corrosion. En faisant l’hypothèse de lois exponentielles entre les parties anodique et cathodique, on aboutit à la relation de Stern et Geary: 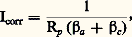 où 廓a et 廓c sont les exposants de la loi de Tafel.Les électrochimistes ont montré que l’exploitation de la courbe de polarisation pouvait être poussée plus avant par la technique d’impédance; celle-ci consiste à introduire une perturbation de type sinusoïdal de faible amplitude, et à suivre la réaction de l’interface métal-solution; on va déterminer ainsi l’impédance complexe Z, et étudier les variations de la résistance et de la capacité en fonction de la fréquence. On confronte ensuite les données expérimentales aux résultats déduits de modèles cinétiques.Le problème de la corrosion sous contrainte se pose fréquemment. Pour le résoudre, on peut utiliser les méthodes précédentes, en soumettant simultanément le métal à une contrainte appliquée (cette contrainte peut être résiduelle comme dans le cas du soudage par exemple). En fait, le problème peut se compliquer par l’intervention d’un phénomène supplémentaire très important, celui de la fragilisation du métal, souvent due à la diffusion d’hydrogène dans le métal; la présence d’hydrogène résulte en particulier de la réaction cathodique de décharge du proton H+ en solution.Absorption des gaz dans les métauxLes gaz dissous dans les métaux, même en faible quantité, ont une influence marquée sur les propriétés mécaniques, chimiques et physiques de ceux-ci, ainsi que sur leur comportement à la corrosion. Les différentes techniques utilisées pour étudier la solubilité des gaz dans les métaux sont de deux types: les méthodes indirectes (volumétrique, oxydation interne, perméabilité et échange isotopique) et les méthodes directes (dégazage sous vide, gravimétrie, analyse après trempe). La figure 12 montre le principe de l’un des premiers appareils utilisés au début de ce siècle pour déterminer l’absorption, à l’équilibre, des gaz dans les métaux. La figure 13 illustre quelques résultats obtenus par cette méthode concernant la solubilité de l’hydrogène dans les métaux. De nombreux appareils fondés sur le même principe, mais d’un emploi plus facile et permettant de travailler à pression ou à volume constants, ont été mis au point pour étudier de nombreux systèmes. Cependant, une bonne partie des résultats plus récents concernant l’absorption de l’hydrogène dans les métaux ont été acquis par étude de la perméabilité (fig. 14).La thermogravimétrie a été, en dépit du fait qu’elle soit bien adaptée aux mesures cinétiques, assez peu utilisée pour étudier l’absorption et la diffusion des gaz dans les métaux, probablement en raison de difficultés de mise en œuvre pour assurer des conditions expérimentales données.Le métallurgiste trouve en outre une aide importante auprès des analystes qui, en utilisant soit des méthodes traditionnelles, soit des méthodes plus modernes, mettant notamment en jeu des réactions nucléaires, ont pu abaisser les seuils de détection et apporter, de plus, des informations sur la localisation des gaz analysés dans les matériaux métalliques.Pour étudier un matériau métallique dans des conditions données, le métallurgiste envisage d’abord si la formation de telle ou telle phase est possible ou non en se plaçant dans les conditions d’équilibre. Mais il doit de plus tenir compte de la réalité dynamique des phénomènes et effectuer des mesures cinétiques. Il est donc indispensable d’utiliser conjointement plusieurs techniques expérimentales qui permettent, grâce à des comparaisons, d’avoir non seulement un plus grand degré de confiance dans les résultats obtenus, mais aussi de prendre en compte le maximum de paramètres pouvant jouer sur le comportement de ce matériau métallique. C’est en partie ce souci qui explique la grande variété d’essais physico-chimiques dont dispose le métallurgiste. Cependant, dans la plupart des cas, on ne peut se limiter à ces essais qui doivent être complétés par des essais physiques, mécaniques et métallographiques.
où 廓a et 廓c sont les exposants de la loi de Tafel.Les électrochimistes ont montré que l’exploitation de la courbe de polarisation pouvait être poussée plus avant par la technique d’impédance; celle-ci consiste à introduire une perturbation de type sinusoïdal de faible amplitude, et à suivre la réaction de l’interface métal-solution; on va déterminer ainsi l’impédance complexe Z, et étudier les variations de la résistance et de la capacité en fonction de la fréquence. On confronte ensuite les données expérimentales aux résultats déduits de modèles cinétiques.Le problème de la corrosion sous contrainte se pose fréquemment. Pour le résoudre, on peut utiliser les méthodes précédentes, en soumettant simultanément le métal à une contrainte appliquée (cette contrainte peut être résiduelle comme dans le cas du soudage par exemple). En fait, le problème peut se compliquer par l’intervention d’un phénomène supplémentaire très important, celui de la fragilisation du métal, souvent due à la diffusion d’hydrogène dans le métal; la présence d’hydrogène résulte en particulier de la réaction cathodique de décharge du proton H+ en solution.Absorption des gaz dans les métauxLes gaz dissous dans les métaux, même en faible quantité, ont une influence marquée sur les propriétés mécaniques, chimiques et physiques de ceux-ci, ainsi que sur leur comportement à la corrosion. Les différentes techniques utilisées pour étudier la solubilité des gaz dans les métaux sont de deux types: les méthodes indirectes (volumétrique, oxydation interne, perméabilité et échange isotopique) et les méthodes directes (dégazage sous vide, gravimétrie, analyse après trempe). La figure 12 montre le principe de l’un des premiers appareils utilisés au début de ce siècle pour déterminer l’absorption, à l’équilibre, des gaz dans les métaux. La figure 13 illustre quelques résultats obtenus par cette méthode concernant la solubilité de l’hydrogène dans les métaux. De nombreux appareils fondés sur le même principe, mais d’un emploi plus facile et permettant de travailler à pression ou à volume constants, ont été mis au point pour étudier de nombreux systèmes. Cependant, une bonne partie des résultats plus récents concernant l’absorption de l’hydrogène dans les métaux ont été acquis par étude de la perméabilité (fig. 14).La thermogravimétrie a été, en dépit du fait qu’elle soit bien adaptée aux mesures cinétiques, assez peu utilisée pour étudier l’absorption et la diffusion des gaz dans les métaux, probablement en raison de difficultés de mise en œuvre pour assurer des conditions expérimentales données.Le métallurgiste trouve en outre une aide importante auprès des analystes qui, en utilisant soit des méthodes traditionnelles, soit des méthodes plus modernes, mettant notamment en jeu des réactions nucléaires, ont pu abaisser les seuils de détection et apporter, de plus, des informations sur la localisation des gaz analysés dans les matériaux métalliques.Pour étudier un matériau métallique dans des conditions données, le métallurgiste envisage d’abord si la formation de telle ou telle phase est possible ou non en se plaçant dans les conditions d’équilibre. Mais il doit de plus tenir compte de la réalité dynamique des phénomènes et effectuer des mesures cinétiques. Il est donc indispensable d’utiliser conjointement plusieurs techniques expérimentales qui permettent, grâce à des comparaisons, d’avoir non seulement un plus grand degré de confiance dans les résultats obtenus, mais aussi de prendre en compte le maximum de paramètres pouvant jouer sur le comportement de ce matériau métallique. C’est en partie ce souci qui explique la grande variété d’essais physico-chimiques dont dispose le métallurgiste. Cependant, dans la plupart des cas, on ne peut se limiter à ces essais qui doivent être complétés par des essais physiques, mécaniques et métallographiques.
Encyclopédie Universelle. 2012.
